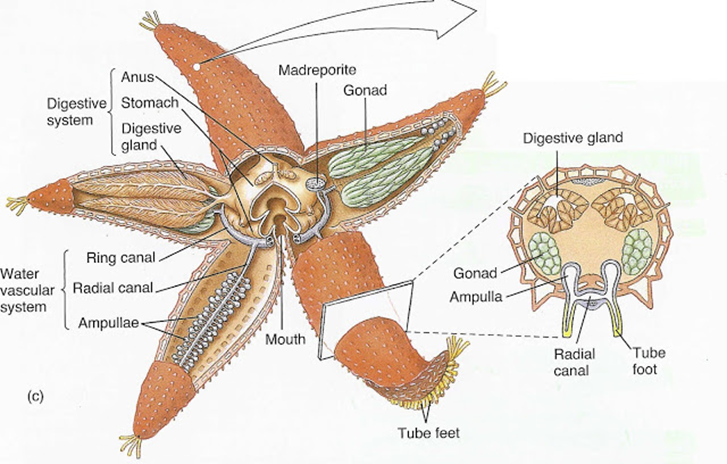
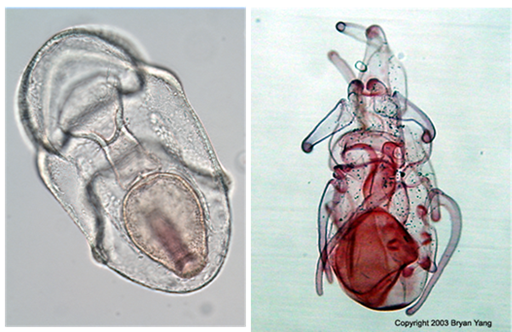
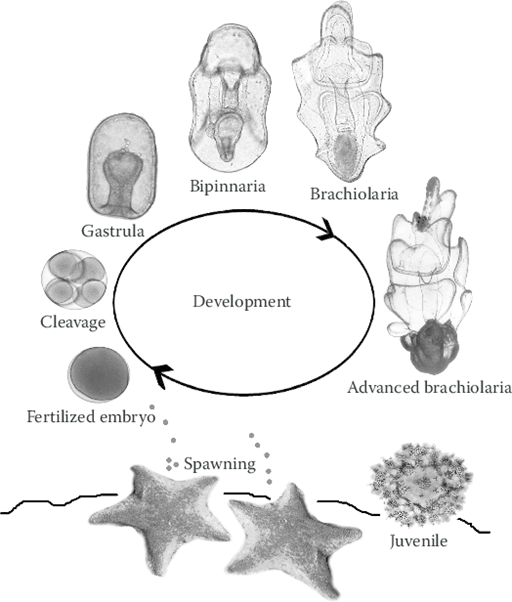
(Ciencias de Joseleg)(Biología)(Reproducción en los seres
vivos)( Reproducción
en invertebrados) (Introducción) (Generalidades)
(Esponjas)
(Cnidarios)
(Platelmintos)
(Nematodos)
(Anélidos)
(Moluscos)
(Crustáceos)
(Insectos)
(Libélulas)
(Mariposas)
(Mosquitos)
(Moscas)
(Abejas)
(Miriapodos)
(Quelicerados)
(Equinodermos)
(Tunicados
y cefalocordados) (Referencias
bibliográficas)
Abbott, J. (2005). Dragonflies and damselflies (Odonata) of Texas (Vol. 1). Lulu. com.
Andersen,
E. H. (1960). Biology, distribution and control of Dermatobia hominis. Veterinary
Medicine, 55, 72–78.
Arikawa, K.
(2001). Hindsight of Butterflies The Papilio butterfly has light sensitivity in
the genitalia, which appears to be crucial for reproductive behavior. BioScience,
51(3), 219–225.
Bates, M.
(1949). The natural history of mosquitoes. The Natural History of
Mosquitoes.
Bayoh, M.
N., & Lindsay, S. W. (2003). Effect of temperature on the development of
the aquatic stages of Anopheles gambiae sensu stricto (Diptera: Culicidae). Bulletin
of Entomological Research, 93(05), 375–381.
Beach, D.
H., Hanscomb, N. J., & Ormond, R. F. G. (1975). Spawning pheromone in
crown-of-thorns starfish. Nature, 254(5496), 135–136.
Beament, J.
W. L., & Lal, R. (1957). Penetration through the egg-shell of Pieris
brassicae (L.). Bulletin of Entomological Research, 48(01), 109–125.
Becker, N.,
Petrić, D., Boase, C., Lane, J., Zgomba, M., Dahl, C., & Kaiser, A. (2003).
Mosquitoes and their control (Vol. 2). Springer.
Bennett, S.
M. (2003). Housefly.
Benoit, J.
B., Attardo, G. M., Baumann, A. A., Michalkova, V., & Aksoy, S. (2015).
Adenotrophic viviparity in tsetse flies: potential for population control and
as an insect model for lactation. Annual Review of Entomology, 60,
351–371.
Bentley, M.
D., & Day, J. F. (1989). Chemical ecology and behavioral aspects of
mosquito oviposition. Annual Review of Entomology, 34(1),
401–421.
Bos, A. R.,
Gumanao, G. S., Mueller, B., & Saceda, M. M. (2013). Size at maturation,
sex differences, and pair density during the mating season of the Indo-Pacific
beach star Archaster typicus (Echinodermata: Asteroidea) in the Philippines. Invertebrate
Reproduction & Development, 57(2), 113–119.
Bradshaw,
W. E. (1980). Blood-feeding and capacity for increase in the pitcher-plant
mosquito, Wyeomyia smithii. Environmental Entomology, 9(1),
86–89.
Brian, M.
V. (1980). Social control over sex and caste in bees, wasps and ants. Biological
Reviews, 55(4), 379–415.
Brues, C.
T. (1936). Aberrant feeding behavior among insects and its bearing on the
development of specialized food habits. The Quarterly Review of Biology,
11(3), 305–319.
Brunetti,
C. R., Selegue, J. E., Monteiro, A., French, V., Brakefield, P. M., &
Carroll, S. B. (2001). The generation and diversification of butterfly eyespot
color patterns. Current Biology, 11(20), 1578–1585.
Brusca, R., Brusca, G. J., & Haver, N. J. (2003). Invertebrates (2nd ed.). Sinauer Associates.
Byrne, M.
(2005). Viviparity in the sea star Cryptasterina hystera
(Asterinidae)—conserved and modified features in reproduction and development. The
Biological Bulletin, 208(2), 81–91.
Capinera,
J. L. (2008). Encyclopedia of entomology. Springer Science &
Business Media.
Chia, F.-S.
(1966). Brooding behavior of a six-rayed starfish, Leptasterias hexactis. The
Biological Bulletin, 130(3), 304–315.
Clements,
A. N. (2013). The Physiology of Mosquitoes: International Series of Monographs
on Pure and Applied Biology: Zoology (Vol. 17). Elsevier.
Cobb, J.
S., & Phillips, B. F. (2012). The biology and management of lobsters:
physiology and behavior. Elsevier.
Corbet, P. S.
(1964). Observations on mosquitoes ovipositing in small containers in Zika
Forest, Uganda. The Journal of Animal Ecology, 141–164.
Corbet, P.
S. (1980). Biology of odonata. Annual Review of Entomology, 25(1),
189–217.
Cournault,
L., & de Biseau, J.-C. (2009). Hierarchical perception of fertility signals
and nestmate recognition cues in two dolichoderine ants. Behavioral Ecology
and Sociobiology, 63(11), 1635–1641.
Crump, R.
G., & Emson, R. H. (1983). The natural history, life history and ecology of
the two British species of Asterina. Field Studies. London, 5(5),
867–882.
Depew, D.
(2000). The Baldwin effect: an archaeology. Cybernetics and Human Knowing,
7(1), 7–20.
DeVries, P.
J. (1988). The larval ant‐organs of Thisbe irenea (Lepidoptera: Riodinidae) and
their effects upon attending ants. Zoological Journal of the Linnean Society,
94(4), 379–393.
DeVries, P.
J. (1990). Enhancement of symbioses between butterfly caterpillars and ants by
vibrational communication. Science, 248(4959), 1104–1107.
Emmel, T.
C. (1976). Butterflies: their world, their life cycle, their behavior. Butterflies:
Their World, Their Life Cycle, Their Behavior.
Evans, K.
W., & Brust, R. A. (1972). Induction and termination of diapause in
Wyeomyia smithii (Diptera: Culicidae), and larval survival studies at low and
subzero temperatures. The Canadian Entomologist, 104(12),
1937–1950.
Factor, J.
R. (1995). Biology of the Lobster: Homarus americanus. Academic Press.
Faull, K.
J., & Williams, C. R. (2015). Intraspecific variation in desiccation
survival time of Aedes aegypti (L.) mosquito eggs of Australian origin. Journal
of Vector Ecology, 40(2), 292–300.
Faustino,
C. D., Silva-Matos, E. V, Mateus, S., & Zucchi, R. (2002). First record of
emergency queen rearing in stingless bees (Hymenoptera, Apinae, Meliponini). Insectes
Sociaux, 49(2), 111–113.
Fischer-Nagel,
H., & Fischer-Nagel, A. (1990). The housefly. Carolrhoda Books.
Gempe, T.,
Hasselmann, M., Schiøtt, M., Hause, G., Otte, M., & Beye, M. (2009). Sex
determination in honeybees: two separate mechanisms induce and maintain the
female pathway. PLoS Biol, 7(10), e1000222.
Gilley, D.
C. (2001). The behavior of honey bees (Apis mellifera ligustica) during queen
duels. Ethology, 107(7), 601–622.
Gordon, P.
M., Hepburn, N. C., Williams, A. E., & Bunney, M. H. (1995). Cutaneous
myiasis due to Dermatobia hominis: a report of six cases. British Journal of
Dermatology, 132(5), 811–814.
Harzsch,
S., & Hafner, G. (2006). Evolution of eye development in arthropods:
phylogenetic aspects. Arthropod Structure & Development, 35(4),
319–340.
Hendler,
G., & Franz, D. R. (1982). The biology of a brooding seastar, Leptasterias
tenera, in Block Island Sound. The Biological Bulletin, 162(3),
273–289.
Heppner, J.
B. (2008). Butterflies and moths (Lepidoptera). In Encyclopedia of
entomology (pp. 626–672). Springer.
Huang, J.,
Walker, E. D., Vulule, J., & Miller, J. R. (2006). Daily temperature
profiles in and around Western Kenyan larval habitats of Anopheles gambiae as
related to egg mortality. Malaria Journal, 5(1), 87.
Jarry, M.,
Gouteux, J.-P., & Khaladi, M. (1996). Are tsetse fly populations close to
equilibrium? Acta Biotheoretica, 44(3), 317–333.
Kaufmann,
C., & Briegel, H. (2004). Flight performance of the malaria vectors
Anopheles gambiae and Anopheles atroparvus. Journal of Vector Ecology, 29,
140–153.
Keesing, J.
K., Graham, F., Irvine, T. R., & Crossing, R. (2011). Synchronous
aggregated pseudo-copulation of the sea star Archaster angulatus Müller &
Troschel, 1842 (Echinodermata: Asteroidea) and its reproductive cycle in
south-western Australia. Marine Biology, 158(5), 1163–1173.
Kimble, J.,
& Crittenden, S. L. (2005). Germline proliferation and its control.
Klowden, M.
J. (2013). Physiological systems in insects. Academic Press.
Kopper, B.
J., Shu, S., Charlton, R. E., & Ramaswamy, S. B. (2001). Evidence for
reproductive diapause in the fritillary Speyeria idalia (Lepidoptera:
Nymphalidae). Annals of the Entomological Society of America, 94(3),
427–432.
Kosova, J.
(2003). Longevity studies of Sindbis virus infected Aedes albopictus.
Kronfeldner,
M. E. (2007). Coalition and Opposition: Heredity, Culture, and the Boundaries
of Anthropology in the Work of Alfred L. Kroeber. A Cultural History of
Heredity IV: Heredity in the Century of the Gene, 61.
Kutschera,
U., & Niklas, K. J. (2004). The modern theory of biological evolution: an
expanded synthesis. Naturwissenschaften, 91(6), 255–276.
Larsen, P.
L. (1993). Aging and resistance to oxidative damage in Caenorhabditis elegans. Proceedings
of the National Academy of Sciences, 90(19), 8905–8909.
Mackensen,
O., & Roberts, W. C. (1948). A manual for the artificial insemination of
queen bees.
Mahbobi,
A., Farshineh-Adl, M., Woyke, J., & Abbasi, S. (2012). Effects of the age
of grafted larvae and the effects of supplemental feeding on some morphological
characteristics of Iranian queen honey bees (Apis mellifera meda Skorikov,
1929). Journal of Apicultural Science, 56(1), 93–98.
McClary, D.
J., & Mladenov, P. V. (1989). Reproductive pattern in the brooding and
broadcasting sea star Pteraster militaris. Marine Biology, 103(4),
531–540.
Miller, R.
L. (1989). Evidence for the presence of sexual pheromones in free-spawning
starfish. Journal of Experimental Marine Biology and Ecology, 130(3),
205–221.
Mukhtar,
M., Ensink, J., Van der Hoek, W., Amerasinghe, F. P., & Konradsen, F.
(2006). Importance of waste stabilization ponds and wastewater irrigation in
the generation of vector mosquitoes in Pakistan. Journal of Medical
Entomology, 43(5), 996–1003.
Nayak, S.,
Goree, J., & Schedl, T. (2004). fog-2 and the evolution of self-fertile
hermaphroditism in Caenorhabditis. PLoS Biol, 3(1), e6.
Neel, W. W., Urbina, O., Viale, E., & De Alba, J.
(1955). Ciclo biológico del tórsalo (Dermatobia hominis L. Jr.) en Turrialba,
Costa Rica. Turrialba, 5(3), 91–104.
Otis, G. W.
(1980). The swarming biology and population dynamics of the Africanized honey
bee. The Swarming Biology and Population Dynamics of the Africanized Honey
Bee.
Otten, E.
J. (2002). Mosquito: A Natural History of Our Most Persistent and Deadly Foe.
Elsevier.
Ottesen, P.
O., & Lucas, J. S. (1982). Divide or broadcast: interrelation of asexual
and sexual reproduction in a population of the fissiparous hermaphroditic
seastar Nepanthia belcheri (Asteroidea: Asterinidae). Marine Biology, 69(3),
223–233.
Pflugfelder,
J., & Koeniger, N. (2003). Fight between virgin queens (Apis mellifera) is
initiated by contact to the dorsal abdominal surface. Apidologie, 34(3),
249–256.
Powell, J.
A. (1987). Records of prolonged diapause in Lepidoptera. J. Res.
Lepid, 25, 83–109.
Ribeiro, M. de F., & Alves, D. de A. (2001). Size variation in Schwarziana
quadripunctata queens (Hymenoptera, Apidae, Meliponini). Rev. Etol, 3(1),
59–65.
Ribeiro, M.
F., Wenseleers, T., Santos Filho, P. S., & Alves, D. A. (2006). Miniature
queens in stingless bees: basic facts and evolutionary hypotheses. Apidologie,
37(2), 191–206.
Riddle, D.
L. (1988). 12 The Dauer Larva. Cold Spring Harbor Monograph Archive, 17,
393–412.
Roberts, D.
(1996). Mosquitoes (Diptera: Culicidae) breeding in brackish water: female
ovipositional preferences or larval survival? Journal of Medical Entomology,
33(4), 525–530.
Run, J.-Q.,
Chen, C.-P., Chang, K.-H., & Chia, F.-S. (1988). Mating behaviour and
reproductive cycle of Archaster typicus (Echinodermata: Asteroidea). Marine
Biology, 99(2), 247–253.
Ruppert, E.
E. B., Fox, R. D., Ruppert, R. S. E. E., Fox, R. S., & Barnes, R. D.
(2004). Invertebrate zoology: a functional evolutionary approach.
Schappert,
P. J., & Schappert, P. (2000). A world for butterflies: their lives,
behavior and future. Firefly Books.
Schlaepfer,
G. G. (2006). Butterflies. Marshall Cavendish.
Schowalter,
T. D. (2016). Insect ecology: an ecosystem approach. Academic Press.
Scoble, M.
J. (1992). The Lepidoptera. Form, function and diversity. Oxford
University Press.
Seeley, T.
D. (1997). Honey bee colonies are group-level adaptive units. The American
Naturalist, 150(S1), s22-S41.
Seeley, T.
D. (2009). The wisdom of the hive: the social physiology of honey bee colonies.
Harvard University Press.
Seeley, T.
D., & Buhrman, S. C. (1999). Group decision making in swarms of honey bees.
Behavioral Ecology and Sociobiology, 45(1), 19–31.
Shepard,
J., & Guppy, C. (2011). Butterflies of British Columbia: including western
Alberta, southern Yukon, the Alaska panhandle, Washington, northern Oregon,
northern Idaho, and northwestern Montana. UBC Press.
Shimanuki,
H., Flottum, K., & Harman, A. (2007). The ABC & XYZ of bee culture. AI
Root Co., Medina, Ohio.
Sikkim, K.
(2004). Protective devices of the carnivorous butterfly, Spalgis epius (Westwood)(Lepidopteraz
Lycaenidae). Current Science, 87(5).
Sota, T.,
& Mogi, M. (1992). Survival time and resistance to desiccation of diapause
and non‐diapause eggs of temperate Aedes (Stegomyia) mosquitoes. Entomologia
Experimentalis et Applicata, 63(2), 155–161.
Tarpy, D. R., Gilley, D. C., & Seeley, T. D. (2004). Levels of selection in a social
insect: a review of conflict and cooperation during honey bee (Apis mellifera)
queen replacement. Behavioral Ecology and Sociobiology, 55(6),
513–523.
Thorson, G.
(1950). Reproductive and larval ecology of marine bottom invertebrates. Biological
Reviews, 25(1), 1–45.
Wallace, J.
R. (2004). Mosquito Overwintering Ecology. In Encyclopedia of Entomology
(pp. 1476–1477). Springer.
Ward, R. A.
(1970). Tsetse fly colonization (Diptera: Muscidae, Glossina spp.). Bulletin
of the Entomological Society of America, 16(2), 111–115.
Weitzel,
T., Jawień, P., Rydzanicz, K., Lonc, E., & Becker, N. (2015). Culex pipiens
sl and Culex torrentium (Culicidae) in Wrocław area (Poland): occurrence and
breeding site preferences of mosquito vectors. Parasitology Research, 114(1),
289–295.
West, L. S.
(1951). The Housefly. Its Natural History, Medical Importance, and Control. The
Housefly. Its Natural History, Medical Importance, and Control.
Wigglesworth,
V. B. (1933). The adaptation of mosquito larvae to salt water. Journal of
Experimental Biology, 10(1), 27–36.
Winston, M.
L. (1991). The biology of the honey bee. harvard university press.
Wirtz, P.,
& Beetsma, J. (1972). Induction of caste differentiation in the honeybee
(Apis mellifera) by juvenile hormone. Entomologia Experimentalis et
Applicata, 15(4), 517–520.
Woodward,
H. (2000). THE BIRDER’S BUG BOOK. The Wilson Bulletin, 112(2),
304.
Zaspel, J.
M. (2016). The Insects: An Outline of Entomology. The Oxford University
Press.