(Ciencias de Joseleg)(Biología)(Reproducción en los seres
vivos)( Enfermedades reproductivas) (Introducción)(Generalidades)(Introducción
al VIH)(Etapas
de la infección por VIH)(Virus
oportunistas)(Bacterias
oportunistas)(Protistos
oportunistas)(Hongos
oportunistas)(Otros
síntomas del SIDA)(Transmisión
y contagio)(SIDA
infantil)(Taxonomía)(Genética)(Como
ingresa el VIH al cuerpo, tropismo)(Respuesta
inmune)(Ciclo
de vida del VIH)(Diversidad
y adaptabilidad del VIH)(Diagnostico)(Efecto
del VIH en el sistema inmune)(Prevención,
tratamiento y epidemiología del VIH)(Descubrimiento
del VIH y el SIDA)(VIH,
historia y sociedad)(Controversias
sociales y negacionismo del VIH y el SIDA)(Algunas
infecciones de transmisión sexual)(Desordenes
reproductivos masculinos)(Desordenes
reproductivos femeninos)(Referencias
bibliográficas)
El VIH es capaz de estimular una amplia variedad de células del sistema inmune, algunas son infectadas activamente, y en otros casos simplemente se manipulan con el fin de facilitar el contacto del virus con su célula blanco gracias al sistema de aglomeración de células del sistema inmune, las interleuquinas.
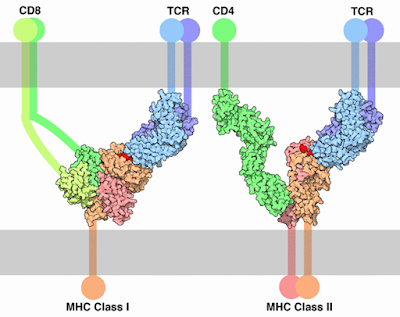
Figura 49. Receptores CD4 y CD8. CD4
interactúa con el complejo mayor de histocompatibilidad del tipo II, mientras
que el CD8 interactúa con el complejo mayor de histocompatibilidad del tipo I.
La GP120 imita al complejo mayor de histocompatibilidad del tipo II y una
citoquina, pero aparentemente no es capaz de imitar el complejo mayor de
histocompatibilidad del tipo I.
Los
linfocitos T CD8 no son afectados directamente por el VIH, l pregunta es ¿Por
qué? Aunque desde la perspectiva de los códigos, la expresión CD4 Y CD8 no son
muy diferentes, desde la perspectiva de la estructura molecular los receptores
son bastante diferentes. El clúster de diferenciación clase 8 es una
glicoproteína transmembranal que sirve como correceptor para el receptor
general TCR. El CD8 interactúa con un complejo mayor de histocompatibilidad de
forma semejante al CD4, el asunto es que existen dos complejos de
histocompatibilidad, el tipo II y el tipo I. En consecuencia, es incapaz de
infectar los linfocitos T CD8+
Los
viriones del VIH son incapaces de acoplarse al receptor CD8 o a los receptores
de los linfocitos B, pero esto no implica que la infección no los afecte.
Existe una diversidad de defectos en la población de linfocitos B inducida por
la infección por VIH de forma indirecta. En los individuos inmunocompetentes
VIH negativo, la mayoría de sus linfocitos B se encuentran o en estado inactivo
o en estado de memoria, no más. En los individuos con infecciones por VIH se
hacen presentes subpoblaciones de linfocitos B, los cuales son anormales desde
una perspectiva poblacional. Estas incluyen linfocitos B transicionales
inmaduras, linfocitos B agotados, linfocitos B activos maduros y plasmoblastos.
Muchos de los defectos de los linfocitos B se atribuyen a la expansión o
contracción de una o más de las subpoblaciones de linfocitos B. Estas
alteraciones, junto con los mecanismos de evasión del virus, ayudan a explicar
las deficiencias en las respuestas de los anticuerpos contra el VIH y otros
patógenos en la etapa de VIH.
Existen
interacciones directas entre los viriones del VIH y los linfocitos B, aun
cuando el virión no pueda ingresar a las células, las pueden afectar. Existen
evidencia que sugiere que el VIH puede acoplarse a los receptores CD21,
DC-SIGN, BCR/VH3+ de los linfocitos B. Se ha postulado que esta interacción
estimula al linfocito la producción de citoquinas que median en la atracción de
los linfocitos B efectores y macrófagos, facilitando al VIH la presencia de sus
células blanco.
En
resumen, el VIH se pega al linfocito B para estimularlo, esto hace que el
convoque al linfocito CD4 y además que el linfocito B se lo presente al
linfocito CD4 facilitando la infección por un proceso no estocastico. Se ha
propuesto un mecanismo similar entre el VIH y las células dendríticas
foliculares que también expresan el receptor CD21.
Existen
tres consecuencias principales de la infección del VIH en los linfocitos B: la
hiperactividad de los linfocitos B, la anemia de los linfocitos B y el
agotamiento de los linfocitos B po no expresión del receptor CR21.
·
La hiperactividad refiere a una sobre-estimulación de las
poblaciones linfocitarias B, lo cual induce la atracción de los linfocitos
T/CD4 y los macrófagos a las regiones donde están los linfocitos B activados
acelerando la infección.
·
La anemia hace referencia a la disminución de poblaciones
como los linfocitos B inactivos, porque son activados demasiado rápido.
·
Agotamiento hace referencia a la activación muy acelerada de
los linfocitos inactivos, lo cual impide su adecuado desarrollo y actividad
inmune. El agotamiento es un fenómeno de las infecciones crónicas que son
capaces de evadir el efecto del sistema inmune.
Los mecanismos de inhabilitación de los linfocitos B y la disfunción generalizada del sistema inmune en los individuos en etapa subclínica y avanzada del VIH fueron difíciles de tratar antes de la terapia efectiva de antiretrovirales. Los antiretrovirales se han convertido en mecanismos de investigación para poder entender los mecanismos de patogenicidad del VIH.
Figura 50. VIH y linfocitos B.
Aparentemente la respuesta de los linfocitos B es óptima en infecciones agudas,
en las que se generan de forma adecuada los plasmoblastos y los linfocitos B de
memoria "azul" que poseen una buena producción de Interferones e
interleuquinas, poseen un potencial de proliferación alto y una baja tendencia
al suicidio. Si la infección se hace crónica, los linfocitos van agotándose,
acumulando receptores y perdiendo sus capacidades para proliferar, recibir o
mandar interleuquinas, producir inmunoglobulinas además de tender al suicidio
celular.
Se ha
demostrado que, con la terapia de antiretrovirales, varias de las anormalidades
de los linfocitos B inducidas por la infección del VIH pueden revertirse, pero
otras no. Particularmente los linfocitos B de memoria retienen algunas
anormalidades incluso por varios años de control efectivo vía terapia de
antiretrovirales.
Si el
virus del VIH-1 aumenta mucho en la etapa aguda, ¿Por qué no desencadena
inmediatamente una etapa de SIDA? O ¿Por qué el sistema inmune es capaz de
responder en la etapa aguda de la infección por VIH? Esta pregunta no puede
responderse si se piensa que todos los linfocitos T CD4+ funcional del mismo
modo. Las cepas M-trópicas R5 son las más comunes en la infección inicial con
VIH-1, representando aproximadamente el 90%, y permanecen siendo las cepas
dominantes durante la etapa asintomática. Esta es una primera explicación con
respecto a las preguntas planteadas, sin embargo aunque no todos los linfocitos
del cuerpo son atacados, aún hay cierta población que parece ser atacada por
virus X4 T-trópicas.
Los linfocitos T CD4+ en la sangre no expresan el receptor CCR5, pero eso no implica que todos los tejidos linfoides del tipo T CD4 sigan el mismo patrón.
Figura 51. Intestinos y VIH. Los
pliegues del intestino poseen nódulos linfáticos que controlan la biota
intestinal y protegen contra las infecciones, adicionalmente estos linfocitos
expresan el receptor CCR5 lo que los convierte en blanco inicial de la
infección por VIH-1 de la cepa R5. El tejido linfoide sanguíneo y el linfoide
gastrointestinal están intercomunicados mediante linfocitos T CD4+ que pueden
infiltrarse y transferirse entre ambos.
Durante esta primera infección aguda, el intestino es afectado gravemente debido a la gran cantidad de nódulos linfáticos que hay en el intestino, estos se inflaman y degradan creando una fuerte gastroenteritis. En contraste, el receptor CXCR4 es expresado solo en los linfocitos de las poblaciones en sangre y no en el tracto gastrointestinal, el problema es que esta versión es proliferativa y sincitial, típica de la etapa de SIDA.
Figura 52. Conversión R5/X4. Las
cepas R5 siguen siendo altamente representativas en los individuos subclínicos,
es decir, aquellos con más de 200 células por milímetro cúbico "primeras
tres columnas", al ingresar en la etapa de SIDA, la cantidad de viriones
X4 aumenta tres a seis veces.
Debido
a que el VIH-1 de la cepa R5 predominan en la etapa aguda y en la etapa de
latencia, las primeras células del sistema inmune linfoide atacadas son las del
sistema gastrointestinal y los pulmones, pero las poblaciones en sangre se
mantienen, y más aún, las poblaciones de sangre que se infiltran al tejido
acatado permanecen inalteradas y permiten el inicio de la respuesta inmune
contra el VIH durante la etapa aguda y de latencia.
La
aparición de las cepas X4 durante la etapa subclínica ocurre temprano
aproximadamente en el 50% de las infecciones con VIH-1 del clado B. Este
proceso se denomina cambio del correceptor. Una vez que empiezan a circular
variantes X4 en la sangre, el tejido linfoide sanguíneo se convierte en el
blanco de ataque, y la respuesta inmune contra el VIH deja de ser efectiva. Lo
anterior se encuentra asociado con un progreso a la etapa de SIDA avanzado en
poco tiempo. Estos individuos poseen una probabilidad entre 30 y 70 veces más
alta de tener sus linfocitos T CD4 inactivos destruidos que un individuo con
cepas R5.
La
disminución acelerada y específica de los linfocitos T CD4+ de la sangre
después de la aparición de las variantes X4 representa el golpe clave al
sistema inmune, hasta este punto el VIH y el sistema inmune se encuentran en un
estado de equilibrio y el VIH se desarrolla como si fuera un comensal.
Los
estudios del VIH-1 así como de otros lentivirus como el VIS han demostrado que
el tejido linfoide que es atacado durante la etapa aguda es efectivamente los
que se encuentran en el tracto gastrointestinal y los pulmones.
Paradójicamente, los linfocitos T CD4 no activos son altamente resistentes a la
infección por el VIH, pero el VIH desencadena una respuesta inmune que en lugar
de destruirlo favorece su propagación. Estudios in vitro han mostrado que una
vez que los linfocitos T CD4 inactivos son tratados con citoquinas activadoras
se hacen altamente susceptibles a la infección por el VIH.
El VIH
no puede replicarse adecuadamente en células que se encuentran fuera de la
etapa del ciclo celular llamada G1b, aunque su ADN puede estar integrado al
ADN. Una vez que la célula alcanza la etapa G1b su ADN se activa y se
sintetizan las sustancias del virión. A pesar de que una célula en G1b no
produce viriones, es capaz de mantener el ADN viral integrado. Para el caso de
los linfocitos T CD4+ de memoria, el ADN puede permanecer integrado sin
producir partículas virales, haciendo de estos reservorios ideales.
Un
linfocito T que expresa las GP160 puede hacerse blanco de anticuerpos, o
mediante el complejo mayor de histocompatibilidad I puede hacerse blanco de los
linfocitos T CD8+ citotóxicos. Pero los linfocitos con ADN no expresivo no son
atacados por el sistema inmune, lo cual explica la persistencia del VIH.
Durante
las infecciones in vitro con células T humanas se ha determinado dos mecanismos
diferentes para la infección: Difusión en fase fluida y sinapsis viral.
Adicionalmente existan otra forma in vivo y es la formación de sincitios en las
cepas X4. La primera forma es la infección en
fase fluida, en esta los viriones se encuentran fuera de las células y
se acoplan al blanco.
Figura 53. Infección en fase
fluida.
Debido a que en este caso el virión está expuesto al ataque del sistema inmune es el mecanismo menos eficiente de infección. La segunda es la sinapsis viral, en esta los viriones proyectan sinapsis, extensiones celulares que permiten aproximarse a células blanco cercanas aun estando dentro de su anfitrión. Este es un mecanismo que permite evadir el sistema inmune.
Figura 54. Sinapsis viral.
Figura 55. Formación de sincitios.
La
tercera es la formación de sincitios, las
células de la cepa X4 hace que el linfocito infectado absorba linfocitos
circundantes creando una macrocélula polinucleada. Debido a que el VIH nunca
sale, el sistema inmune no puede atacar al VIH de forma correcta. Formación de
sincitios, una célula anfitriona interactúa (A) con una célula blanco
funsionándola (B), el núcleo fusionado es infectado internamente (C). El VIH
infecta en estado de ácido nucleico por lo que el sistema inmune no puede
atacarle facilmente.
El VIH
sería un comensal molesto pero tolerable si no poseyera factores de
patogenicidad, es decir rasgos que lo transforman en un parásito en lugar de un
comensal inocuo. Otros lentivirus similares al VIH poseen mecanismos de
patogenicidad diferentes como el oncogén que induce la formación de tumores. El
VIH posee mecanismos de patogenicidad que inducen el suicidio celular pero no
por apotosis, sino por citólisis celular. El proceso involucra la activación de
proteasas de aspartato-cisteinila llamadas caspasas. Algunos genes virales como
Vpr y Env codifican proteínas que son citotóxicos, tanto en el contexto in
vitro aisladas del virus o en el contexto de una infección in vivo.
Debido
a que la citotoxicidad del VIH es efectiva tanto desde el interior de la célula
“in vivo” como desde el exterior de la célula “in vitro”, se ha propuesto que
en la etapa avanzada del SIDA los linfocitos T CD4+ son eliminados aun cuando
no han sido infectados. Los linfocitos T infectados al morir liberan viriones y
citotoxinas que inducirán la muerte celular de las células alrededor. El efecto
por daño colateral de testigos funciona mediante la siguiente analogía. Si el
linfocito T infectado muere por la citotoxina del VIH, los linfocitos testigos
alrededor también mueren, no por la infección sino por la citotoxina.
Adicionalmente
los sincitios tienden a la apoptosis una vez que alcanzan cierto tamaño
crítico, estas células al ser muy voluminosas, almacenan enormes cantidades de
citotoxinas. Este efecto representa el golpe de gracia de la infección del VIH
contra los linfocitos T CD4+
Todos
los lentivirus conocidos retienen a capacidad de infectar y replicar los
macrófagos e su etapa final de desarrollo. A diferencia de los oncovirus
–aquellos lentivirus que poseen el oncogén causante del cáncer –que requieren
una célula en mitosis, específicamente la etapa de disociación de la membrana
del núcleo para poder completar su ciclo infectivo, el VIH puede infectar
productivamente células estancadas en la etapa G1 –pero no en una pequeña
sub-etapa después de la mitosis llamada G0.
La
etapa G0 se denomina arresto del ciclo de vida, y es una etapa en la cual la
célula no se divide de forma prolongada. G1 es la primera etapa de crecimiento
celular. Este proceso es mediado por las proteínas de la capside y del complejo
de preintegracion, compuesto por algunas proteínas del interior de la cápside y
por el genoma viral. Este complejo atraviesa los poros nucleares.
En los
individuos VIH-1 positivos, los macrófagos infectados contribuyen no solo a la
primera etapa de la infección, también se encargan de diseminar los viriones
del VIH hacia el sistema nervioso central a través de la barrera
hematoencefálica. El VIH-1 y la enfermedad neuronal no están bien entendidos
aun, pues aun que los síntomas neuronales se manifiestan preferentemente en la
etapa de SIDA, el VIH como tal invade la región cerebral pronto durante la
etapa aguda.
El
endotelio de los capilares nerviosos permite el paso restringido a algunos
linfocitos, pero solo los macrófagos "rosado" pueden infiltrarse en
el endotelio hacia el cerebro. Sin los macrófagos están produciendo viriones
inician la etapa de infección neuronal de astrocitos "limitada" y
microgliales, las cuales producen neurotoxinas que matan las neuronas. Se
piensa que los vectores principales de tráfico del VIH son los macrófagos,
linfocitos y posiblemente monocitos inactivos.
El
VIH-1 es incapaz de infectar las neuronas debido a que estas no expresan en
receptor CD4 o los correceptos CCR5, CXCR4 o CCR3, pero a cambio infectan los
macrófagos perivasculares, dendríticas y las células microgliales. Varios
factores han sido propuestos para explicar la razón de que los síntomas del
neuro-SIDA se manifiesten tarde a pesar de que la infección es temprano. La
primera –que ha sido mencionada anteriormente –es la hipoxia, aparentemente las
microgliales expresan los receptores que las hacen vulnerables a la infección
cuando el cerebro posee bajos niveles de oxígeno –lo cual presupone problemas
pulmonares propios de la etapa del SIDA.
La
segunda razón, es que la enfermedad neuronal se manifiesta solo cuando las
células infectadas forman sincitios. La cepa que forma sincitios –X4 –aparece
muy tarde en la infección por VIH, lo cual contribuye a que la neuropatía asociada
al VIH solo se manifiesta en la etapa del SIDA. La enfermedad neuronal asociada
al SIDA se observa entre el 40% y el 70% de los individuos.
La replicación del VIH-1 en el linaje monocitario –monocitos, macrófagos, dendríticas –así como la que sucede en las microgliales persiste fuertemente en los pacientes que reciben un tratamiento con antirretrovirales debido a que estas moléculas son poco eficientes en atravesar la barrera hematoencefálica. Adicionalmente el VIH puede infectar de forma no proliferativa las astrogliales, las células de Langerhans y algunas neuronas. Esto convierte al cerebro en un reservorio para el VIH-1, que junto a los linfocitos T CD4+ latentes –infectados pero que no expresan proteínas virales –contribuyen a la reaparición rápida de la viremia en el momento en que el tratamiento se retira. Tome en cuenta que este mecanismo de resistencia es completamente independiente a las mutaciones de resistencia, y de hecho estos mecanismos le otorgan al VIH el tiempo suficiente para generar mutantes resistentes.
Figura 56. Vacuolas de latencia. El
VIH puede tener una segunda forma latente, y es mediante la formación de
vacuolas no digestivas al interior del macrófago (a), el cual puede activarse
(b) para formar una infección proliferativa. Lo anterior contribuye a la
característica fenotípica de las cepas R5, las cuales son de infección lenta y
comensalista, radicalmente diferente de la forma X4 que es rápida y parasítica.
La
noción de modelo es común a todas las ciencias, y en el estudio del VIH también
se hace presente, prácticamente toda la información que se conoce a cerca de la
replicación del VIH en los macrófagos se ha adquirido mediante métodos in
vitro. La replicación activa de la cepa M-trópica en el linaje monocitario
requiere que el monocito sea activado hasta llegar a la etapa de macrófago o
dendrítica in vitro. Adicionalmente, las células del linaje monocitario
expresan menores cantidades de los receptores CD4 y CCR5 y aún menos de los
CXCR4 y CCR3. Esto hace que la infección del VIH en el linaje monocitario sea
extremadamente ineficiente.
Las células
dendríticas son células procesadoras y presentadoras de antígeno por la ruta
del complejo mayor de histocompatibilidad de tipo II y del tipo I, por lo cual
es capaz de interactuar con los linfocitos T CD4+ y CD8+. Han sido
identificadas dos subpoblaciones de las células dendríticas, las células
dendríticas mieloides y las células dendríticas plasmacitoides. Las células
dendríticas mieloides son una de las puertas de entrada para el VIH y
simultáneamente la primera línea de defensa, que al atacar paradójicamente
favorece la infección. Esto se debe a que las células dendríticas mieloides se
encuentran en la mucosa genital y en el tracto gastrointestinal. El Segundo
tipo de células dendríticas, llamadas plasmocitoides son menos abundantes, pero
se encuentran en el plasma sanguíneo, los nódulos linfáticos y el timo,
adicionalmente son convocadas por interleuquinas inflamatorias.
Después
de la activación, las células dendríticas mieloides segregan interleuquina 12,
mientras que las células dendríticas plasmocitoides producen interferones del
tipo I y citoquinas inflamatorias. En consecuencia, las células dendríticas
plasmocitoides tienden a bloquear a los viriones –los interferones bloquean la
acción de los retrovirus de forma inespecífica. Como se mencionó anteriormente,
las células dendríticas mieloides son el mayor talón de Aquiles del sistema
inmune en las formas del VIH contagiadas a través de vías sexuales. Estas
células son el primer blanco del VIH, pero aparte de infectarlas, las estimula.
Las células dendríticas son células presentadoras de antígeno, por lo que sus
interleuquinas convocan a los linfocitos T CD4+. Es importante recalcar que, en
la etapa inicial, los linfocitos no son atacados ya que son cepas R5 del VIH,
el problema es que las dendríticas pasan los virus a los macrófagos que pueden
entrar en contacto con el sistema gastrointestinal al patrullar, y los
linfocitos de esa región si son vulnerables. Al estimular a las células dendríticas
mieloides, estas convocan la respuesta inmune, atrayendo los macrófagos,
linfocitos B y linfocitos T, lo cual favorece la dispersión de la infección por
VIH. Adicionalmente, las células dendríticas mieloides y otras células inmunes
transportan las partículas virales hacia los nódulos linfáticos, lo cual da
inicio definitivo a la etapa aguda de la infección del VIH.
Las
células dendríticas son poco comunes en la sangre, por lo que su estudio con
respecto al VIH depende de experimentos in vitro de monocitos manipulados para
que se transformen en células dendríticas. Al igual que en los macrófagos, las
células dendríticas expresan pocos receptores clave para la infección del VIH,
pero la cantidad de receptores aumenta desde su estado como monocito hasta ser
una célula dendrítica activa y madura. Esto implica que los monocitos son
difíciles de infectar, pero las células maduras son más fáciles. Aun así, en
comparación con un linfocito T CD4+, las células dendríticas maduras son más
difíciles de infectar, lo cual contribuye al fenotipo lento de las cepas
M-trópicas –monocitos, macrófagos y dendríticas.
Inmunofluoresencia
en verde ha mostrado que el VIH-1 no solo ataca las células dendríticas,
también se pegan de forma no infectiva a la superficie del VIH, lo cual
favorece la infección por sinapsis viral durante la presentación de antígeno a
los linfocitos T CD4+. El VIH a través de la sinápsis viral puede permanecer
muy poco tiempo como virión, lo cual le ayuda a evadir al sistema inmune
humoral. Nuevamente este tipo de infección solo ocurre en la etapa aguda en los
nódulos linfáticos del intestino y los pulmones, pero se manifiesta
paulatinamente en la sangre solo al llegar a la etapa de SIDA. Más aun,
estudios recientes han mostrado que los viriones pueden permanecer en vesículas
a la espera de la célula dendrítica entre en contacto con los linfocitos T
CD4+, momento en el cual el VIH avanza hacia el exterior quedando unida a una
sinapsis viral. Estas vesículas se forman por el intento de la célula
dendrítica de formar un fagosoma y degradar el VIH, pero este puede permanecer
sin ser eliminado en algunas ocaciones. Las células mieloides tienden a
presentar todos estos problemas, mientras que las plasmocitoides están
protegidas debido a que, en lugar de citoquinas, liberan interleuquinas que
bloquean la acción general de los lentivirus como el VIH.
Del mismo modo que sucede con los linfocitos B, el VIH-1 puede interactuar con receptores de los neutrófilos, la célula inmune reconoce al VIH-1 como si fuera una citoquina –cosa que hace para acoplarse a los correceptores CCR5 y CXCR4 de cualquier forma –pero en lugar de ingresar para atacar a la célula, el neutrófilo es activado. En este caso el neutrófilo migra a ganglios linfáticos expresando a su vez citoquinas que disminuyen la actividad de los linfocitos. Los neutrófilos estimulados por el VIH se denominan PD-L1 y la ruta de supresión del sistema inmune mediada por los neutrófilos sobre los linfocitos de llama PD-1. Esta ruta fue reportada en 2013 y representa un mecanismo de patogenicidad alternativo del VIH para suprimir al sistema inmune.






No hay comentarios:
Publicar un comentario