(Ciencias de Joseleg)(Biología)(Reproducción en los seres
vivos)(Reproducción en aves) (Introducción) (Temporadas
y territorios reproductivos) (Sistema
reproductor) (Hormonas
sexuales) (Gametogénesis) (Emparejamiento
y cortejo) (Selección
sexual) (Desarrollo
embrionario del pollo) (El
huevo) (Nidada
e incubación) (Referencias
bibliográficas)
Desde que Aristóteles siguió por primera vez su desarrollo de 3 semanas, el pollo doméstico ha sido un organismo favorito para los estudios embriológicos. Es accesible todo el año y se cría fácilmente. Además, a cualquier temperatura particular, su etapa de desarrollo puede predecirse con precisión. Así, se pueden obtener grandes cantidades de embriones en la misma etapa. El embrión de pollo se puede manipular quirúrgicamente y, dado que forma la mayoría de sus órganos de manera muy similar a la de los mamíferos, a menudo ha servido como sustituto de los embriones humanos.
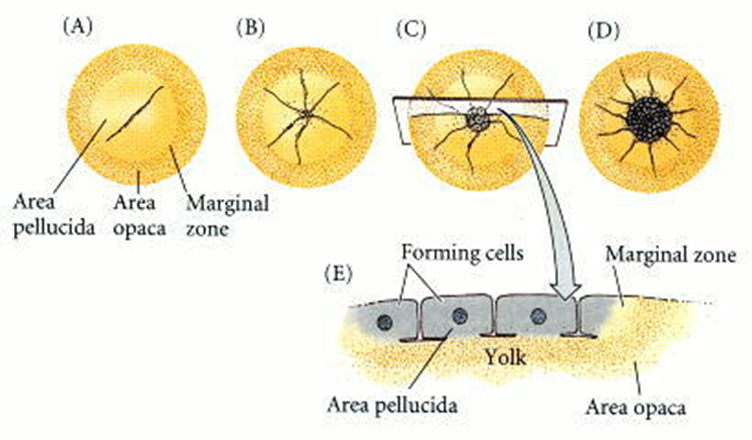
Figura 37. Escisión meroblastica discoidal en
un huevo de gallina. (A-D) Cuatro etapas vistas desde el polo animal (el lado
dorsal futuro del embrión). (E) Un embrión de escisión temprana visto desde el
lado.
La fertilización del huevo de gallina ocurre en el oviducto,
antes de que la albúmina y la cáscara se segreguen sobre él. El huevo es
telolecítico (como el del pescado), con un pequeño disco de citoplasma sentado
sobre una gran yema.
Al igual que los huevos de pescado, los huevos de yema de
las aves se someten a escisión meroblastica discoidal “La división solo afecta
a un disco citoplasmático próximo al polo animal y la parte inferior (polo
vegetativo) no se segmenta; a continuación, se forma un disco de blastómeros,
el blastodermo o blastodisco, a partir del cual se formará el embrión, que
reposará sobre la masa vitelina. Se da en peces, reptiles y aves, entre otros”.
La escisión se produce solo en el blastodisco, un pequeño disco de citoplasma
de 2 a 3 mm de diámetro en el polo animal de la célula del huevo. El primer
surco de escisión aparece centralmente en el blastodisco, y otras escisiones
siguen para crear un blastodermo de una sola capa (Figura 37).
Al igual que en el embrión de pescado, estas escisiones no se extienden en el
citoplasma de la yema, por lo que las células de escisión temprana son
continuas entre sí y con la yema en sus bases (Figura 38-E).
Posteriormente, las divisiones ecuatoriales y verticales dividen el blastodermo en un tejido de cinco a seis capas de células de espesor. Estas células se unen entre sí mediante uniones estrechas.
Figura 38. Formación
del blastodermo de dos capas del embrión de pollo. (A, B) Las células primarias de hipoblasto se
deslaminan individualmente para formar islas de células debajo del epiblasto.
(C) Las células de hipoblasto secundarias del margen posterior (la hoz de
Koller y las células marginales posteriores detrás de él) migran debajo del
epiblasto e incorporan las islas de polinvaginación. A medida que el hipoblasto
se mueve anteriormente, las células epiblastas se acumulan en la región
anterior a la hoz de Koller para formar la veta primitiva. (D) Esta sección
sagital de un embrión cerca del margen posterior muestra una capa superior que
consiste en un epiblasto central que se introduce en las células de la hoz de
Koller (ks) y la zona marginal posterior (mz). Ciertas células se deslaminaron
del epiblasto (ep) para formar islas de polinvaginación (pi) de 5 a 20 células
cada una. Estas células se unirán a aquellas células hipoblastas (hip) que
migran anteriormente de la hoz de Koller para formar la capa inferior
(hipoblástica secundaria). (sc, cavidad subgerminal; gwm, margen de la pared
germinal.)
Cuando una gallina ha puesto un huevo, el blastodermo contiene unas 20,000 células. En este momento, la mayoría de las células de la zona pelúcida permanecen en la superficie, formando el epiblasto, mientras que otras células de la pelúcida área se deslaminaron y migraron individualmente hacia la cavidad subgerminal para formar las islas de polinvaginación (hipoblasto primario), un archipiélago de agrupaciones desconectadas que contiene 5-20 células cada una (Figura 38-B). Poco después, una lámina de células del margen posterior del blastodermo (que se distingue de las otras regiones del margen por la hoz de Koller, un engrosamiento local) migra anteriormente para unirse a las islas de polinvaginación, formando así el hipoblasto secundario.
Figura 39.
Movimientos celulares de la línea primitiva del embrión de pollo. (A-C) Vista
dorsal de la formación y elongación de la veta primitiva. El blastodermo se
observa en (A) 3-4 horas, (B) 7-8 horas y (C) 15–16 horas después de la
fertilización. Los primeros movimientos de las células epiblastas que migran se
muestran mediante flechas. (D-F) Formación de somitas de notocordio y
mesodérmicas a medida que la raya primitiva retrocede, mostrada en (F) 19–22
horas, (E) 23–24 horas, y (F) la etapa de cuatro somitas. Los mapas de destino
del epiblasto de pollo se muestran para dos etapas, la etapa de raya primitiva
definitiva (C) y la neurulación (F). El endodermo ya ha penetrado debajo del
epiblasto, y se observa una extensión convergente en la línea media.
El blastodermo de dos capas (epiblasto e hipoblasto) se une
en el margen del área de opaca, y el espacio entre las capas forma un
blastoceloma. Por lo tanto, aunque la forma y la formación del blastodisco
aviar difieren de las de la blástula de anfibios, peces o equinodermos, se
mantienen las relaciones espaciales generales.
El embrión aviar proviene enteramente del epiblasto. El
hipoblasto no contribuye con ninguna célula al embrión en desarrollo. Más bien,
las células hipoblastas forman porciones de las membranas externas,
especialmente el saco vitelino y el tallo que une la placa de la yema al tubo
digestivo endodérmico. Las tres capas germinales del embrión propiamente dicho
(más una cantidad considerable de membrana extraembriónica) se forman a partir
de las células epiblastas. Los mapas de destino del epiblasto de pollo se
muestran en (Figura
39).
La principal característica estructural de la gastrulación
aviaria, reptiliana y de mamíferos es el tallo primitivo. Esta raya se ve
primero como un engrosamiento del epiblasto en la región posterior del embrión
“hacia el dorso”, justo delante de la hoz de Koller (Figura 39-A).
Este engrosamiento es causado por la entrada de precursores endodérmicos desde
el epiblasto al blastoceloma y por la migración de células desde la región
lateral del epiblasto posterior hacia el centro (Figura 39-B).
Cuando estas células entran en la línea primitiva, la línea se alarga hacia la
región de la cabeza futura. Al mismo tiempo, las células de hipoblasto
secundarias continúan migrando anteriormente del margen posterior del
blastodermo. El alargamiento del tallo primitivo parece ser coextensivo con la
migración anterior de estas células de hipoblasto secundario. El tallo
eventualmente se extiende 60–75% de la longitud del área pelúcida.
El tallo primitivo define los ejes del embrión. Se extiende
desde la parte posterior a la anterior; las células migratorias entran a través
de su lado dorsal y se mueven hacia su lado ventral; y separa la parte
izquierda del embrión de la derecha. Los elementos cercanos al tallo serán las
estructuras mediales (centrales), mientras que los más alejados serán las
estructuras distales (laterales) (Figura 39-C,
E).
Cuando las células convergen para formar el tallo primitivo, se forma una depresión dentro del propio tallo. Esta depresión se denomina surco primitivo y sirve como una abertura a través de la cual las células migratorias pasan al blastoceloma. Por lo tanto, el surco primitivo es análogo al blastoporo de anfibios. En el extremo anterior del tallo primitivo hay un engrosamiento regional de las células llamado nudo primitivo o nodo de Hensen. El centro de este nodo contiene una depresión en forma de embudo (a veces llamada fosa primitiva) a través de la cual las células pueden pasar al blastoceloma. El nodo de Hensen es el equivalente funcional del labio dorsal del blastoporo de anfibios (es decir, el organizador) y el escudo embrionario de los peces.
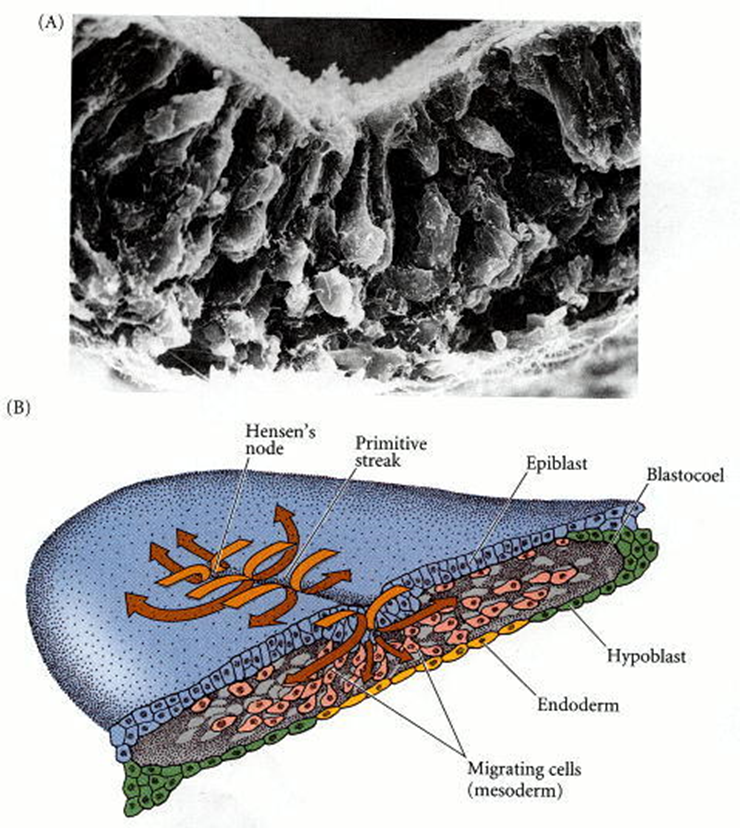
Figura 40. Migración
de células endodérmicas y mesodérmicas a través del tallo primitivo. (A) La
micrografía electrónica de barrido muestra que las células epiblastas pasan al
blastoceloma y extienden sus extremos apicales para convertirse en células de
botella. (B) Estereograma de un embrión de pollo gástrico, que muestra la
relación de la línea primitiva, las células migratorias y las dos capas
originales del blastodermo. La capa inferior se convierte en un mosaico de
células hipoblastos y endodérmicas; Las células de hipoblasto finalmente se
separan para formar una capa debajo del endodermo y contribuyen al saco
vitelino.
Tan pronto como el tallo primitivo se ha formado, las
células epiblastas comienzan a migrar a través de ella y hacia el blastoceloma
(Figura
40).
El tallo primitivo tiene una población celular en continuo cambio. Las células
que migran a través del nodo de Hensen pasan al blastoceloma y migran en la
parte anterior, formando las vísceras superiores, cabeza del mesodermo y
notocorda; Las células que pasan a través de las porciones laterales de la
línea primitiva dan lugar a la mayoría de los tejidos endodérmicos y
mesodérmicos. A diferencia del mesodermo de Xenopus, que migra como láminas de
células al blastoceloma, las células que ingresan en el interior del embrión
aviar ingresan como individuos después de sufrir una transformación epitelial a
mesenquimatosa. Se cree que la descomposición de la lámina basal y la
liberación de estas células en el embrión se llevan a cabo en el nodo de Hensen
a lo largo del tallo primitivo por un factor de dispersión, una proteína de 190
kDa segregada por las células cuando entran en la hendidura. El factor de
dispersión puede convertir las láminas epiteliales en células mesenquimales de
varias maneras, y es probable que esté involucrado tanto en la disminución de
la expresión de E-cadherina como en la prevención del funcionamiento de la
E-cadherina.
Las primeras células que migran a través del nodo de Hensen
son aquellas destinadas a convertirse en el endodermo faríngeo de las vísceras
superiores. Una vez dentro del blastoceloma, estas células endodérmicas migran
anteriormente y eventualmente desplazan a las células hipoblastas, lo que hace
que las células hipoblastas se confinen a una región en la porción anterior del
área pelúcida. Esta región, la media luna germinal, no forma ninguna estructura
embrionaria, pero contiene los precursores de las células germinales, que luego
migran a través de los vasos sanguíneos a las gónadas. Las siguientes células
que entran en el blastoceloma a través del nódulo de Hensen también se mueven
en sentido anterior, pero no se mueven tan ventralmente como las células
endodérmicas presuntivas. Más bien, permanecen entre el endodermo y el
epiblasto para formar la cabeza del mesénquima y el mesodermo de la placa
precordena. Estas células de ingreso temprano se mueven en sentido anterior,
empujando hacia arriba la región de la línea media anterior del epiblasto para
formar el proceso de la cabeza (Figura
41).
Así, la cabeza del embrión aviar se forma anterior (rostral) al nodo de Hensen.
Las siguientes células que migran a través del nodo de Hensen se convierten en
células de acordesodermo (notocordas). Estas células se extienden hasta el
presunto cerebro medio, donde se encuentran con la placa precordal. El cerebro
posterior y el tronco se forman a partir del cordamesodermo a nivel del nodo de
Hensen y caudal a él.
Mientras tanto, las células continúan migrando hacia adentro
a través de la porción lateral del tallo primitivo. Cuando entran en el blastoceloma,
estas células se separan en dos capas. La capa profunda se une al hipoblasto a
lo largo de su línea media y desplaza las células del hipoblasto a los lados.
Estas células de movimiento profundo dan lugar a todos los órganos endodérmicos
del embrión, así como a la mayoría de las membranas extraembrionarias (el
hipoblasto forma el resto). La segunda capa migratoria se extiende entre este
endodermo y el epiblasto, formando una capa suelta de células. Estas células de
la capa media generan las porciones mesodérmicas de las membranas embrionarias
y extraembrionarias. A las 22 horas de incubación, la mayoría de las células
endodérmicas presuntas se encuentran en el interior del embrión, aunque las células
mesodérmicas presuntas continúan migrando hacia adentro durante más tiempo.
Ahora comienza una nueva fase de la gastrulación. Mientras continúa la ingresión mesodérmica, el tallo primitivocomienza a retroceder, moviendo el nodo de Hensen desde cerca del centro de la pelícida del área a una posición más posterior (ver Figura 41). En su retirada el tallo deja a su paso el eje dorsal del embrión y la notocorda. A medida que el nodo se mueve hacia atrás, la notocorda se establece, comenzando en el nivel del futuro cerebro medio. Mientras que la parte anterior de la notocorda se forma por la ingresión de células a través del nódulo de Hensen, la notocorda posterior (después de la somita 17 en el pollo) se forma a partir de la condensación del tejido mesodérmico que ha ingerido a través de la línea primitiva (es decir, no a través del nodo de Hensen). Esta parte de la notocorda se extiende posteriormente para formar la cola del embrión. Finalmente, el nodo de Hensen regresa a su posición más posterior, formando la región anal. En este momento, todas las células endodérmicas y mesodérmicas presuntas han ingresado en el embrión, y el epiblasto está compuesto completamente de células ectodérmicas presuntas.
Figura 41. La
gastrulación de los pollitos de aproximadamente 24 a 28 horas. (A) El tallo
primitivo en plena extensión (24 horas). El proceso de la cabeza (notocorda
anterior) se puede ver extendiéndose desde el nodo de Hensen. (B) Etapa de dos
somitas (25 horas). El endodermo faríngeo se ve anteriormente, mientras que la
notocorda anterior empuja hacia arriba el proceso de la cabeza por debajo. El
tallo primitivo está retrocediendo. (C) Etapa cuatro-somitas (27 horas). (D) A
las 28 horas, el tallo primitivo ha regresado a la porción caudal del embrión.
(E) Regresión del tallo primitivo, dejando el notocordio a su paso. Varios
puntos de la racha (representados por letras) fueron seguidos después de que
alcanzó su longitud máxima. El tiempo representa horas después de alcanzar la
longitud máxima (la línea de referencia, aproximadamente 18 horas después de la
incubación)
Como consecuencia de la secuencia mediante la cual se
establecen el mesodermo de la cabeza y la notocorda, los embriones aviares (y
mamíferos) exhiben un claro gradiente anterior-posterior de la madurez del
desarrollo. Mientras que las células de las porciones posteriores del embrión
están experimentando gastrulación, las células en el extremo anterior ya están
comenzando a formar órganos (la cabeza se forma primero y la cola después).
Durante los próximos días, el extremo anterior del embrión está más avanzado en
su desarrollo (después de haber tenido un "inicio" tardío) con
respecto al extremo posterior.
Mientras que las células mesodérmicas y endodérmicas
presuntas se están moviendo hacia adentro, los precursores ectodérmicos
proliferan. Por otra parte, las células ectodérmicas migran para rodear la yema
de huevo por epibolia. El encierro de la yema por el ectodermo (una vez más
reminiscencia del epibolio del ectodermo de anfibios) es una tarea hercúlea que
toma la mayor parte de los 4 días siguientes para completarse.
Implica la producción continua de nuevo material celular y
la migración de las presuntas células ectodérmicas a lo largo del lado inferior
de la envoltura vitelina. Curiosamente, solo las células del borde exterior del
área de opaca se adhieren firmemente a la envoltura vitelina. Estas células son
intrínsecamente diferentes de las otras células de blastodermo, ya que pueden
extender enormes procesos citoplásmicos (500 μm) a la envoltura vitelina. Se
cree que estos filopodios alargados son el aparato locomotor de estas células
marginales, mediante el cual tiran de las otras células ectodérmicas alrededor
de la yema. Los filopodios parecen unirse a la fibronectina, una proteína
laminar que es un componente de la envoltura vitelina del pollo. Si el contacto
entre las células marginales y la fibronectina se rompe experimentalmente (al
agregar un polipéptido soluble similar a la fibronectina), la retracción de los
filopodios y la migración epidérmica cesa.
Así, a medida que la gastrulación aviar se acerca a su fin, el
ectodermo ha rodeado la yema, el endodermo ha reemplazado al hipoblasto
y el
mesodermo se ha posicionado entre estas dos regiones. Hemos
identificado muchos de los procesos involucrados en la gastrulación aviar, pero
seguimos ignorando los mecanismos por los cuales muchos de estos procesos se
llevan a cabo.
Mientras que la formación de los ejes corporales se logra
durante la gastrulación, su especificación ocurre antes, durante la etapa de
escisión.
El eje dorsal-ventral (parte posterior del vientre) es
crítico para la formación del hipoblasto y para el desarrollo posterior del
embrión. Este eje se establece cuando las células de escisión del blastodermo
establecen una barrera entre la albúmina básica (pH 9.5) que se encuentra por
encima del blastodisco y el espacio subgerminal ácido (pH 6.5) que se encuentra
debajo. El agua y los iones de sodio se transportan desde la albúmina a través
de las células hasta el espacio subgerminal, creando una diferencia de
potencial de membrana de 25 mV a través de la capa de células epiblastas (positiva
en el lado ventral de las células). Este proceso distingue dos lados del
epiblasto: un lado que mira a la albúmina negativa y básica, que se convierte
en el lado dorsal, y un lado que mira al fluido del espacio subgerminal
positivo y ácido, que se convierte en el lado ventral. Este eje se puede
invertir experimentalmente invirtiendo el gradiente de pH o invirtiendo la
diferencia de potencial a través de la capa celular.
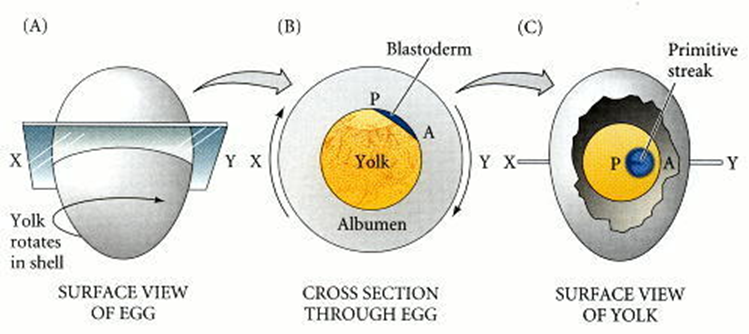
La conversión del blastodermo radialmente simétrico en una estructura bilateralmente simétrica está determinada por la gravedad. A medida que el óvulo atraviesa el tracto reproductivo de la gallina, gira alrededor de 20 horas en la glándula de la concha. Esta hilatura, a una velocidad de 10 a 12 revoluciones por hora, desplaza la yema de modo que sus componentes más ligeros se encuentran debajo de un lado del blastodermo. Esto alza ese extremo del blastodermo, y ese extremo se convierte en la parte posterior del embrión, la parte donde comienza la formación del tallo primitivo.
Figura 42. Organización anterior-posterior por gravedad del embrión del pollo. La rotación en la glándula de la cáscara (A) da como resultado que los componentes más ligeros de la yema empujen hacia arriba a un lado del blastodermo (B). Esa región más elevada se convierte en la parte posterior del embrión (C).
Figura 43. Regulación
del blastodermo de pollo. Cuando el blastodermo se divide en cuatro partes,
cada parte puede iniciar la gastrulación y dar lugar a un embrión (clonación
embrionaria). Por lo general, solo las células de la zona marginal posterior
pueden formar una raya primitiva e inhiben a otras áreas de la zona marginal
para que no lo hagan.
No se sabe qué interacciones hacen que esta porción del
blastodermo se convierta en el margen posterior e inicie la gastrulación. La
capacidad de iniciar el tallo primitivo se encuentra en toda la zona marginal,
y si el blastodermo se separa en partes, cada una con su propia zona marginal,
cada parte formará su propio tallo primitivo (Figura 43).
Sin embargo, una vez que se ha formado una zona marginal posterior (PMZ por sus
siglas en inglés), controla las otras regiones del margen. Estas células PMZ no
solo inician la gastrulación, sino que también evitan que otras regiones del
margen formen sus propios tallos primitivos.
Ahora parece evidente que la PMZ contiene células que actúan
como el equivalente del centro Nieuwkoop de anfibios. Cuando se coloca en la
región anterior de la zona marginal, un injerto de tejido de la zona marginal
posterior (posterior y sin incluir la hoz de Koller) puede inducir una línea
primitiva y un nodo de Hensen sin que las células contribuyan a ninguna de las
estructuras. Al igual que el centro Nieuwkoop de anfibios, se cree que esta
región es el lugar donde la localización de la β-catenina en el núcleo y la
señal de la familia TGF-β coinciden. La zona marginal posterior es la única
región del Vg1 secretor de embriones.
Las células de epiblasto y capa media en la porción anterior de la hoz de Koller se convierten en el nodo de Hensen. La parte posterior de la hoz de Koller contribuye a la parte posterior de la línea primitiva (Figura 44).
Figura 44. Formación
del nodo de Hensen a partir de la hoz de Koller. (A) Diagrama
del extremo posterior de un embrión temprano (antes de la raya), que muestra
las células marcadas con tintes fluorescentes en las fotografías. (B) Justo
antes de la gastrulación, las células en el extremo anterior de la hoz de
Koller (el epiblasto y la capa media) se marcaron con colorante verde. Las
células de la porción posterior de la hoz de Koller se marcaron con tinte rojo.
A medida que las células migran, las células anteriores formaron el nodo de
Hensen y sus derivados de notocordas. Las células posteriores formaron la
región posterior de la línea primitiva. El tiempo después de la inyección de
tinte está etiquetado en cada fotografía.
Desde hace tiempo se sabe que el nodo de Hensen es el
equivalente aviar del labio blastoporo dorsal de anfibios, ya que es (1) el
sitio donde comienza la gastrulación, (2) la región cuyas células se convierten
en el cordamesodermo, y (3) la región cuyas células pueden organice un segundo
eje embrionario cuando se trasplanta en otras ubicaciones de la gástrula.
Además, el trasplante de la hoz de Koller también puede causar la formación de
nuevos ejes, y las células de la capa media en la hoz de Koller expresan
goosecoides, al igual que las células del organizador de Spemann.
Como es el caso en todos los vertebrados, el mesodermo dorsal es capaz de inducir la formación del sistema nervioso central en el ectodermo que lo recubre. Las células del nodo de Hensen y sus derivados actúan como el organizador de los anfibios, y secretan proteínas Cordina, Noggina y Nodal. Los factores de crecimiento de fibroblastos se producen en el nodo de Hensen y en la línea primitiva, y las perlas que contienen ciertos FGF pueden inducir la expresión neuronal del tronco y del cerebro posterior en las células epiblastas.
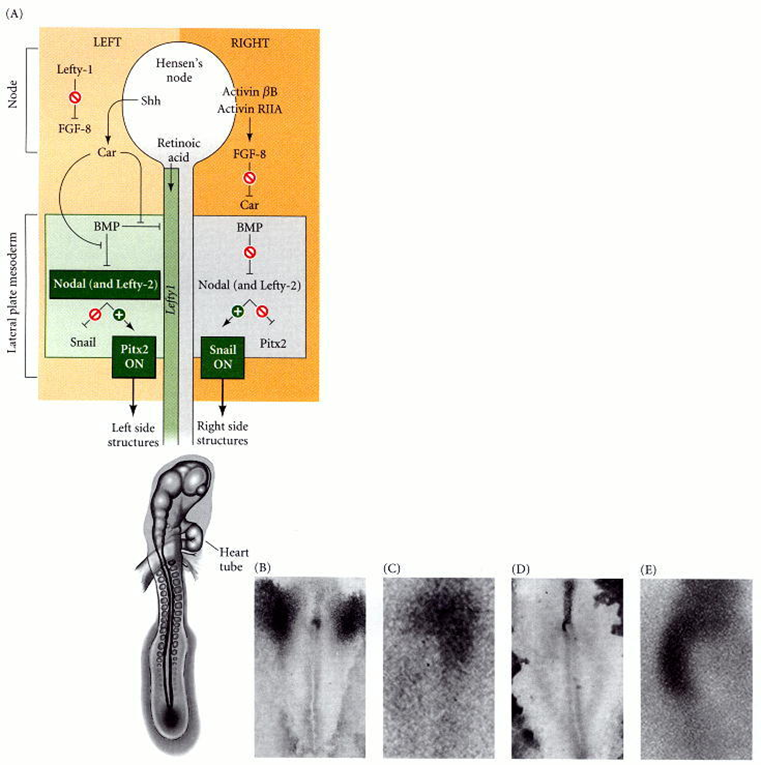
Figura 45. Para la
asimetría izquierda-derecha en el embrión de pollo. (A) Lado izquierdo: en el
lado izquierdo del nodo de Hensen, se expresan sonic hedgehog (shh) y lefty-1. Lefty-1
bloquea la expresión fgf8, mientras que sonic hedgehog activa la expresión de
caronte. Mientras tanto, el ácido retinoico permite la expresión de Lefty-1 a
lo largo de la línea media ventral. La expresión de Caronte bloquea las
proteínas morfogenéticas óseas (BMP) en el lado izquierdo, que de otro modo
bloquearían la expresión de nodal y Lefty-2. En presencia de Nodal y Lefty-2,
el gen pitx2 se activa y el gen del caracol (cSnR) se reprime. Pitx2 está
activo en los diversos primordios de órganos y especifica el lado que se
dejará. En el lado derecho del embrión, la activina se expresa junto con el
receptor de activina IIa. Esto activa FGF8, una proteína que bloquea la
expresión de caronte. En ausencia de Caronte, BMP reprime la activación de
nodal y lefty-2. Esto permite que el gen caracol esté activo mientras que el
gen pitx2 permanece reprimido. (B, C) Vistas dorsales y en primer plano de la
hibridación in situ del ARNm de sonic hedgehog. (D, E) Vistas dorsales y
en primer plano del mensaje del receptor IIa de activina.
Como hemos visto, el cuerpo de los vertebrados no es
simétrico. Más bien, tiene distintos lados derecho e izquierdo. El corazón y el
bazo, por ejemplo, están generalmente en el lado izquierdo del cuerpo, mientras
que el hígado está generalmente en el lado derecho. La distinción entre los lados
derecho e izquierdo de los vertebrados está regulada por dos proteínas
principales: el factor paracrino nodal y el factor de transcripción Pitx2. Sin
embargo, el mecanismo por el cual la expresión génica nodal se activa en el
lado izquierdo del cuerpo difiere entre las clases de vertebrados. La facilidad
con que pueden manipularse los embriones de pollo ha permitido a los
científicos dilucidar las vías de discriminación de izquierda a derecha en aves
más fácilmente que en otros vertebrados.
A medida que la línea primitiva alcanza su longitud máxima,
se genera una cascada de genes homeoticos diferencial entre la derecha y la
izquierda. Esto permite generar los órganos asimétricos como el hígado, el
páncreas, los pulmones y el corazón.
El endodermo origina el epitelio de revestimiento interno de
los sistemas digestivo, inmunológico y respiratorio, y los órganos pueden
visualizarse desde el segundo día (48 h) cuando se forma el hígado. La
formación del sistema digestivo se completó en el día 12. Los órganos del
sistema respiratorio comienzan en el cuarto día como un tejido desorganizado e
indiferenciado. Su diferenciación completa se observa a los 10 días de la
incubación, sin embargo, hasta los 19 días no se observó la siringe. La
formación del sistema inmune al décimo día se observó con la formación del
bazo, el timo y la bolsa cloacal. El estudio de la organogénesis del pollo
basado en capas germinales es muy complejo y está poco explorado, y el estudio
de la embriología del pollo es muy importante debido a la importancia económica
y al crecimiento del uso de este modelo animal, como los estudios genéticos (Alcântara
et al., 2013).